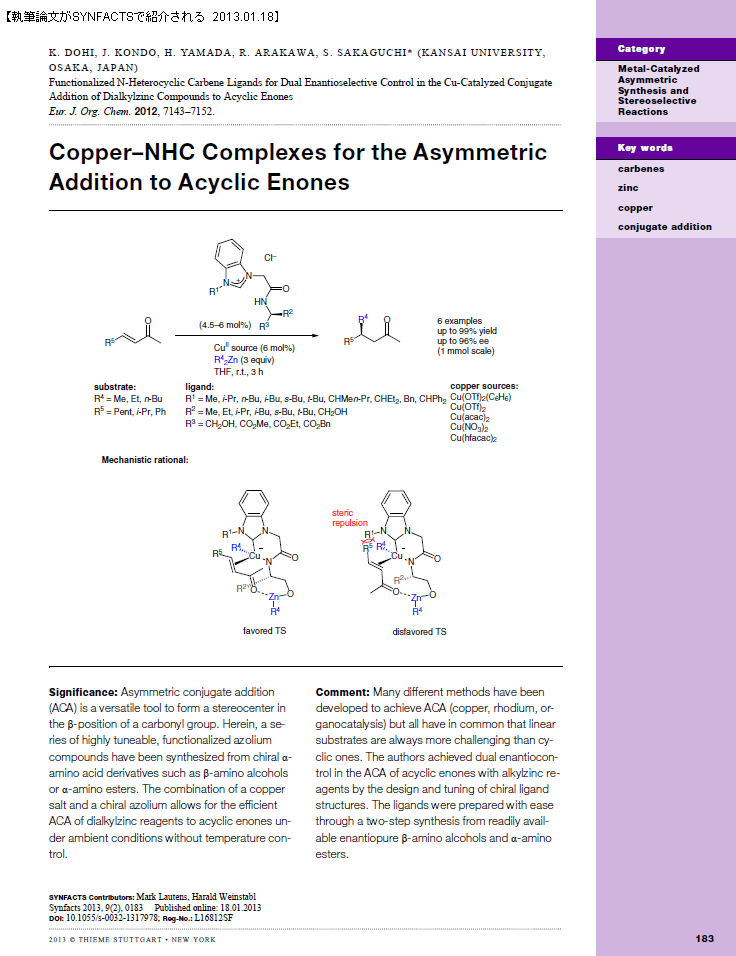
1.はじめに
N-ヘテロサイクリックカルベン(NHC)は、強いσ-ドナー性を持ち、さらにはN-置換基の多様性に基づいてNHCの電子的、立体的性質を任意にチューニングすることが可能であるため、近年有機金属化学の分野で新規なNHC配位子をもつ金属錯体の開発と有機合成化学における触媒反応への応用研究が活発に行われている1)。特にNHC配位子への官能基導入によって、NHCに金属中心へのアンカーとしての役割を持たすことができるため、キレート配位子の構築、中心金属の安定性の制御あるいはキラリティーの導入など金属錯体に様々な機能を付与することが可能になる。NHCに導入する官能基(N-置換基)は、中性官能基とアニオン性官能基に大別できる。そのうち後者のアニオン性官能基を有するNHC配位子は、多座配位型として中心金属に強固に配位するため、金属からの配位子の離脱を抑制できるという利点がある。またN-置換基上にキラリティーを導入した場合、NHC配位子上の立体配向性置換基が効果的に固定される。
図 1にこれまでに開発されたアニオン性官能基を有するNHC配位子を示す。アニオン性のアルコキシド、アリールオキシド、スルホナート、アミド官能基をもつNHC錯体が分子デザインおよび合成されているが、それらを不斉触媒反応に利用した成功例は限られている。最初の報告は、2002年のHoveydaらによるものであり、アリールオキシド基で置換されたNHC−Ru錯体(B)がオレフィンの分子内不斉メタセシス反応に高い触媒活性を示すことが見出された2)。最も広く研究されているものは、アニオン性アルコキシド置換されたNHC配位子(A)を利用した不斉共役付加反応である3)。これらはいずれもアニオン性酸素を有するのに対し、アニオン性窒素をもつNHC配位子が不斉触媒反応に利用され良好な結果を導いたという報告例はない。2008年に我々は、アニオン性窒素で官能基化されたNHC配位子として従来になかったキラルなアニオン性アミデート置換NHC(E)を報告した4)。本稿では、アニオン性アミデート/NHC−金属錯体ならびに不斉触媒反応に関する我々の研究を中心に紹介する。
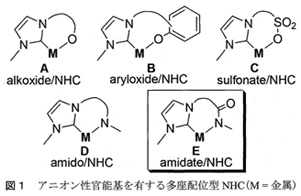
2.アニオン性アミデート/NHC−Pd錯体触媒による非環状アルケンの分子間不斉Heck型反応
2.1 キラルNHC配位子の分子デザイン
官能基化されたNHCの前駆体は、一般に取り扱いが容易で安定性のよい置換アゾリウム塩である。またアゾリウム塩は、その合成を既存の合成手法を利用して極めて容易に行えるという特徴をもつ。このことが緒言に記したNHCの分子構造に多様性をもたらし、NHC配位子の電子的、立体的性質のチューニングを可能にする。我々は、キラルNHC(その前駆体アゾリウム塩)をデザイン・合成するために、多種多様な化合物が安価に入手できる天然アミノ酸に注目した。図2に、本研究でデザインしたα-アミノ酸から誘導可能なアニオン性アミデート官能基化されたキラルNHC配位子を、金属種と錯体形成させ不斉触媒反応に利用するための方策を示した。NHCとアニオン性アミデート基が近傍に存在するため、中心金属に対して多座で強固に配位することが期待される。また、配位子の不斉点が中心金属近傍に位置しており、α-アミノ酸のキラリティー(R1基)を有効に活用できると考えられる。
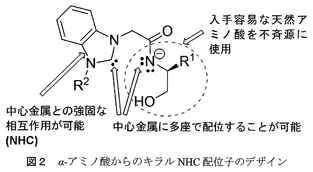
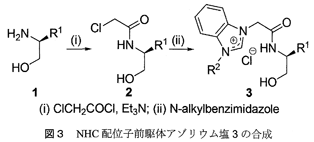
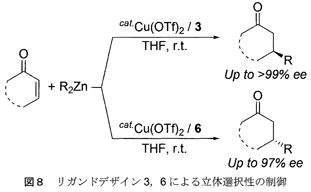
図3には、本研究で開発したアニオン性アミデート官能基をもつキラルNHCの前駆体であるアゾリウム化合物3を得るための合成ルートを示した5)。α-アミノ酸の還元体であるキラルなβ-アミノアルコール1と塩化クロロアセチルから得られたアミド化体2を置換アゾールとカップリングさせることで、目的のヒドロキシ-アミド官能基化されたアゾリウム塩3が良好な収率で合成できた。3は空気中で安定であり特別な注意を払うことなく長期間保存可能な白色固体である。また、入手容易な出発物質からわずか二段階で効率良くNHC配位子前駆体を調製できることは、これまで開発されてきた中性あるいはアニオン性官能基を有するNHC配位子の大半が多段階を経て低収率で合成されることを考慮すると、特筆すべき点である。
2.2 アニオン性アミデート/NHC−Pd錯体
ヒドロキシ-アミド官能基化されたアゾリウム塩3は、3つの酸性水素を有する。すなわち、アゾリウム環上の水素、アミド基ならびに水酸基中の水素であるが、よく知られているアゾリウム化合物、アミドおよびアルコールのpKa値を参考にすると、アゾリウム環上水素が最も強い酸性であると示唆された。アゾリウム塩が脱プロトン化されるとNHCへ変換されるが、3からNHC−Pd錯体の合成は試行錯誤の結果、Linらによって開発された酸化銀法を採用したところ、室温下短時間で容易に行えることがわかった(図4)6)。すなわち3とAg2OをCH2Cl2中室温で反応させると、アゾリウム環水素の位置選択的な脱プロトン化によるNHCの形成と同時にAg種との錯形成が起こり、NHC−Ag錯体が定量的に得られた。NHC−Ag錯体には配位子上のヒドロキシ基とアミド基が残存しており、この段階でアニオン性NHC錯体は形成されないことがわかった。続いて得られたAg錯体をPdCl2(CH3CN)2とCH3CN中室温下反応させると、配位子交換反応が生起し、NHC−Pd錯体4が黄橙色の固体として得られた。Pd錯体4は、1H-および13C-NMR測定、元素分析ならびに単結晶X線構造解析によって、多座配位型アニオン性アミデート/NHC−Pd錯体であることが明らかになった4)。
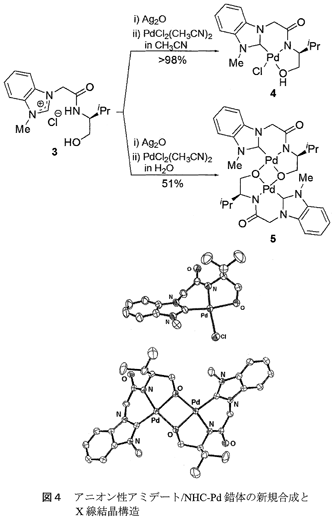
さらに興味深いことに、NHC−Ag錯体とPdCl2(CH3CN)2の反応を水中で行うことによって、ジアニオン性アルコキシ/アミデート/NHC−Pd錯体5が生成することを見出した(図4)。錯体5の構造もX線構造解析を含め各種分光学的手法により解明した。このように、錯体調製時の反応溶媒の選択により異なる二種類のNHC−Pd錯体を合成できることがわかった。これらの錯体はいずれも従来に報告例のなかった新しいタイプのキラルなアニオン性アミデート/NHC錯体であり、空気中でも安定で取り扱い容易な化合物である。また、アニオン性アミデート種の形成には配位子上の水酸基の存在が重要であることも明らかにした7)。
2.3 非環状アルケンの分子間不斉Heck型反応
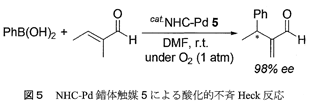
Pd触媒よるハロゲン化アリールとアルケンのHeck反応は、有機合成化学における合成ツールの一つとして広く利用されている。不斉Heck反応に関して従来開発された触媒系の多くは、分子内反応のみに適用される。環状アルケンの分子間不斉Heck反応についての例はいくつかあるのに対し、立体配座の自由度が大きいためその反応の立体化学の制御が困難である鎖状アルケンを高エナンチオ選択的に反応させることは極めて困難であった。我々は、キラルなアニオン性アミデート/NHC−Pd錯体を触媒に利用すると、困難とされてきた鎖状アルケンの分子間不斉Heck型反応が効率良く進行することを見出した。アニオン性アルコキシ/アミデート/NHC−Pd錯体5が有効であった。触媒量の5存在下、フェニルボロン酸とtrans-2-メチル-2-ブテナールを酸素雰囲気のもとDMF中反応させたところ、酸化的Heck反応が生起し、対応するクロスカップリング生成物が生成した (図5)。この反応における生成物の鏡像体過剰率は98% eeに達した8)。従来、同様な不斉触媒反応が二座配位型の中性ピリジン/オキサゾリン配位子を有するPd錯体を用いて行われているが、その不斉収率は75% eeであった9)。アニオン性官能基をもつNHC−Pd種を用いることで、従来法を凌駕する反応になった。また、NHC−Pd錯体触媒5は、種々のアリールボロン酸と非環状ならびに環状アルケンの酸化的Heck反応に適用可能で、対応する生成物が高エナンチオ選択的に得られることを明らかにしており、本法は一般性の高い不斉触媒反応系である。
3.Cu触媒による不斉共役付加反応における立体選択性の逆転
3.1 同一配位子を用いた両鏡像体生成物のつくりわけ
Cu触媒による不斉共役付加反応は様々な生理活性物質の合成に使え、炭素−炭素結合形成反応として極めて有用である。緒言で記述したアニオン性アルコキシド置換されたNHC配位子(A)の前駆体であるヒドロキシ-アルキル置換アゾリウム塩は、Cu触媒と組み合わせて使用することにより、共役エノンとアルキル化試薬のエナンチオ選択的1,4-付加反応を促進する3)。我々は、Pd触媒反応で効果的に働いたヒドロキシ-アミド官能基化されたアゾリウム塩3 (Eの前駆体)がCu触媒による不斉共役付加反応にも有用なキラル配位子となり、しかもヒドロキシ-アルキル置換アゾリウム塩(Aの前駆体)では観察されなかった同一配位子の使用による立体選択性の逆転という現象を見出した(図6)10)。
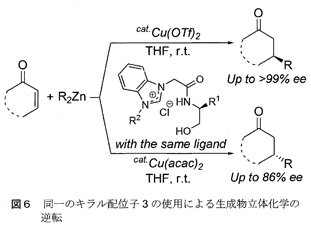
Cu触媒による不斉共役付加反応は様々な生理活性物質の合成に使え、炭素−炭素結合形成反応として極めて有用である。緒言で記述したアニオン性アルコキシド置換されたNHC配位子(A)の前駆体であるヒドロキシ-アルキル置換アゾリウム塩は、Cu触媒と組み合わせて使用することにより、共役エノンとアルキル化試薬のエナンチオ選択的1,4-付加反応を促進する3)。我々は、Pd触媒反応で効果的に働いたヒドロキシ-アミド官能基化されたアゾリウム塩3 (Eの前駆体)がCu触媒による不斉共役付加反応にも有用なキラル配位子となり、しかもヒドロキシ-アルキル置換アゾリウム塩(Aの前駆体)では観察されなかった同一配位子の使用による立体選択性の逆転という現象を見出した(図6)10)。
一般に不斉触媒反応において立体化学の異なる生成物をつくりわけるには、不斉配位子に両エナンチオマーを利用する必要がある。天然物を配位子の不斉源にする場合、両エナンチオマーの入手が困難であることが多い。本反応は、天然アミノ酸から誘導される不斉配位子のみの使用で、非天然物に頼ることなく、不斉触媒反応において両鏡像体生成物をつくりわけできる画期的な手法である。本法は立体配置が異なる両光学活性体を簡便に得る合成法を提供し、既存の技術と比べ低コストで工程が短く、生産性が高い方法になり得ることが予想される。
|
|
3.2 キラル配位子デザインによる両鏡像体生成物のつくりわけ
ヒドロキシ-アミド官能基化されたアゾリウム塩3は、天然α−アミノ酸の還元体であるβ−アミノアルコール1から合成するが、新たなキラル配位子の分子デザインとしてα−アミノ酸のエステル化体の利用を考案した(図7)。α−アミノエステルはβ−アミノアルコール1と比較して、種類が豊富でより安価に入手できる。図3に示す合成経路において1の代わりにα−アミノエステルを用いたところ、エステル-アミド官能基化されたアゾリウム塩6が良好な収率で合成できることがわかった11)。
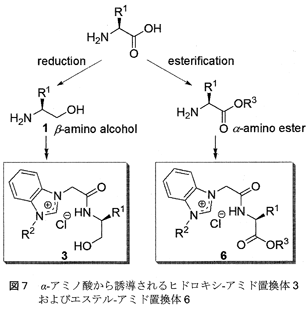
6を不斉触媒反応におけるキラル配位子に利用するために検討を重ねた結果、セリンエステルから誘導したアゾリウム塩6が不斉共役付加反応において高活性を示すことを見出した(図8)。触媒量のCu(OTf)2と6の共存下、環状エノンとジアルキル亜鉛を反応させると、対応する共役付加生成物がほぼ定量的な収率で得られ、エナンチオ過剰率は最高で97% eeとなった。興味深いことに、先のヒドロキシ-アミド官能基化されたアゾリウム塩3を用いる不斉共役付加反応で得られた生成物と比べると、アゾリウム塩6による触媒反応は立体化学が逆転した生成物を与えた。このように、同じ不斉源となる物質(天然α−アミノ酸類)から分子構造の異なる二種類の配位子デザインによって、不斉触媒反応の立体選択性を制御できることが明らかになった。
4.Ir触媒によるケトンの不斉還元反応
4.1
IPAを用いる水素移動型還元反応
遷移金属錯体触媒を用いるケトンのアルコールによる水素移動型還元反応は、有機合成化学において最も基本的な官能基変換反応の一つである。従来9族遷移金属のキラルなNHC錯体が開発され、不斉触媒反応への利用が数多く試みられてきた。しかし、アセトフェノン(7)のような単純ケトンの還元における不斉収率は高々40% ee程度であり、安定性が良く取り扱いが容易なNHC−金属錯体を利用した還元反応に有効な触媒系の開発は、チャレンジングな課題である。我々は、Ir種が移動水素化反応を触媒することに着目し12)、またヒドロキシ-アミド官能基を有するNHC 3が、PdやCuを用いる不斉触媒反応に限らず、他の触媒反応にも利用可能な万能配位子“privileged ligand”になることを期待して、新規なNHC−Ir錯体の合成ならびにケトンの不斉触媒反応について検討した。
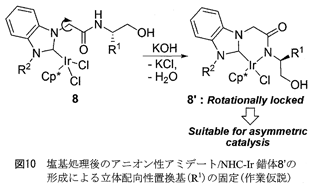
3からNHC−Ir錯体8の合成は、(Cp*IrCl2)2をIr種前駆体に用い、NHC−Pd錯体の合成の際に採用した酸化銀法を利用すると容易に行えた13)。合成したCp*IrCl2(NHC)錯体8の分子構造は、NMR、元素分析ならびに単結晶X線構造解析によって解明され、NHCがIrに単座配位しており、NHC置換基上のヘテロ原子と中心金属間の相互作用は認められなかった(図9)。先に示したPd錯体4は、多座配位型アニオン性アミデート/NHC錯体であるのに対し、Ir錯体8は単座配位型の錯体であることは興味深い。しかしこのことは、不斉触媒反応への利用を困難にする要因になると思われた。すなわち、図10の8に示すように、NHC上の置換基における自由回転のため、立体配向性置換基(R1基)が効率良く働かないと考えられた。
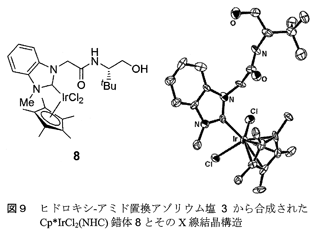
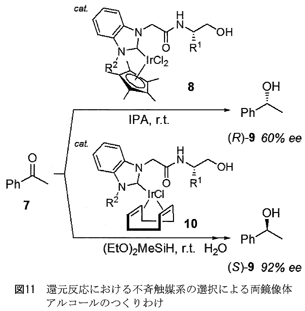
そこで、Ir錯体8を塩基で処理すれば脱HCl化が起こり、アニオン性アミデート錯体の形成によて結合が固定されるため(8’)、立体配向性置換基(R1基)を活用した不斉触媒反応系の構築が可能になると考えた(図10)。一般に水素移動型還元反応は塩基存在下で行われるため、8を用いる触媒反応系中ではアミデート種の形成が可能になり、結合の自由回転を抑制できると期待された。実際、触媒量のCp*IrCl2(NHC)錯体8を用いて、KOH存在下アセトフェノン(7)とイソプロピルアルコール(IPA)の反応を室温条件のもと行うと、期待した通りエナンチオ選択的に反応が進行し、目的生成物である(R)-1-フェニルエタノール(9)が60% eeで得られることが明らかになった(図11)。これまでに、NHC−Ir錯体触媒を用いる不斉還元反応が、室温のもと進行したという報告はほとんどない。また本法は、還元反応の不斉収率に関しても、従来法を凌駕する結果となった。
4.2 不斉ヒドロシリル化を利用した還元反応:不斉触媒反応系の選択による両鏡像体生成物のつくりわけ
ケトンのヒドロシリル化反応により得られる生成物は温和な条件のもと短時間で容易に対応するアルコール体へ変換できるため、簡便なケトンの還元法になる。我々は、ヒドロキシ-アミド官能基化されたアゾリウム塩3と[IrCl(cod)]2から調製したIrCl(cod)(NHC) 錯体10がケトンの高エナンチオ選択的なヒドロシリル化反応を触媒することを見出した14)。IrCl(cod)(NHC) 錯体10は、これまでと同様に酸化銀を利用した手法により高収率で合成でき、Cp*IrCl2(NHC)錯体8と同様、単座配位型のNHC−Ir錯体であることがわかった。アセトフェノン(7)の不斉ヒドロシリル化反応について、シリル化剤や添加剤および反応溶媒など様々な触媒反応条件を検討した。その結果、安価な(EtO)2MeSiHをシリル化剤に利用し、IrCl(cod)(NHC) 錯体10に少量のAgBF4を添加した触媒系で室温下反応させた後、ヒドロシリル化生成物を加水分解すると、(S)-1-フェニルエタノール(9)が92% eeで得られることが明らかになった(図11)。この場合、配位子の不斉源であるアミノ酸にロイシンを用いると良好な結果を与えた。特筆すべきことに、先述のCp*IrCl2(NHC)錯体8とIPAによるアセトフェノン(7)の触媒的水素移動型還元反応は、Rの絶対配置をもつアルコール生成物9を優先して与えたのに対し、IrCl(cod)(NHC)錯体触媒10を用いたヒドロシリル化反応で得られたアルコール9の絶対配置は、Sであった。このように、同じ天然α−アミノ酸から誘導した配位子の利用で、不斉触媒反応系の工夫によって、立体化学の異なる二種類の光学活性アルコールをつくりわけるという新しい合成手法を確立した。
5.おわりに
NHCを鍵化合物に利用し、アニオン性アミデート官能基を導入したキラルな多座配位子をデザインした。キラル配位子を合成するために、入手容易なα−アミノ酸を原料に選択し、NHC配位子前駆体となる新規なヒドロキシ-アミド官能基化されたアゾリウム塩を創製した。本配位子の特徴の一つに、種々の誘導体を極めて簡便な手法で合成できることが挙げられる。このため、不斉触媒反応のキラル配位子として利用する際に、その反応に適した分子構造を有する配位子のチューニングを容易に行える。本稿では、最適化した配位子上の置換基(R1およびR2基)に関しての詳細は省略したため、原著をご参考いただきたい。ここで開発したキラル配位子は様々な不斉触媒反応に利用でき、それぞれ従来にない特徴的な反応を見出すことができた。今後、本キラル配位子の有機触媒としての利用15)も含め多くの有用な有機化学反応への展開とともに、アニオン性官能基を有する新規なNHC配位子のデザインおよびその触媒能について検討する予定である。
謝辞
本稿で紹介した研究成果の一部は、米国南カリフォルニア大学(USC)のDr. K.W. Jungおよび故Dr. K.S. Yooとの共同研究であり、この場を借りて御礼申し上げます。また本研究を遂行するにあたり、ご協力いただいた参考文献に氏名を記載した関西大学大学院理工学研究科ライフ・マテリアルデザイン専攻の大学院生諸氏に感謝申し上げます。本研究の一部は、平成22年度ならびに平成23年度(独)科学技術振興機構(JST) 研究成果最適展開支援プログラム(A-STEP)【FS】探索タイプの支援を受けて行われました。
参考文献
1) (a) N-Heterocyclic Carbenes; S. Diez-Gonzalez, Ed.; RSC-Publishing:
Cambridge, 2011; (b) Functionalised N-Heterocyclic Carbene Complexes; O.
Kuhl; WILEY-VCH: Weinheim, 2010; (c) L. Benhamou,; E. Chardon, G. Lavigne,
S. Bellemin-Laponnaz, V. Cesar, Chem. Rev., 111, 2705 (2011)
2) J.J. Van Veldhuizen, S.B. Garber, J.S. Kingsbury, A.H. Hoveyda, J. Am. Chem. Soc., 124, 4954 (2002)
3) (a) K. Takatsu, R. Shintani, T. Hayashi, Angew. Chem. Int. Ed., 50, 5548 (2011); (b) M. Tissot, A.P. Hernandez, D. Muller, M. Mauduit, A. Alexakis, Org. Lett., 13, 1524 (2011); (c) M. Mauduit, D. Marc, WO 2008135386 (2008)
4) (a) S. Sakaguchi, K.S. Yoo, J. O’Neill, J.H. Lee, T. Stewart, K.W. Jung,
Angew. Chem. Int. Ed., 47, 9326 (2008); (b) K.W. Jung, K.S. Yoo, S. Sakaguchi, C.P. Park, J. O’Neill,
J.H. Lee, US 20100036131 (2010); アミデートでなくアミダトとも呼ばれるが、本原稿ではアミデートと表記した。英語ではamidate。
5) S. Sakaguchi, M. Kawakami, J. O’Neill, K.S. Yoo, K.W. Jung, J. Organomet. Chem., 695, 195 (2010)
6) I.J.B. Lin, C.S. Vasam, Coord. Chem. Rev., 251, 642 (2007)
7) R. Kamisue, S. Sakaguchi, J. Organomet. Chem., 696, 1910 (2011)
8) K.S. Yoo, J. O’Neill, S. Sakaguchi, R. Giles, J.H. Lee, K.W. Jung, J. Org. Chem., 75, 95 (2010)
9) K.S. Yoo, C.P. Park, C.H. Yoon, S. Sakaguchi, J. O’Neill, K.W. Jung,
Org. Lett., 9, 3933 (2007)
10) (a) M. Okamoto, Y. Yamamoto, S. Sakaguchi, Chem. Commun., 7363 (2009); (b) N. Shibata, M. Okamoto, Y. Yamamoto, S. Sakaguchi, J. Org. Chem., 75, 5707 (2010); (c) A. Harano, S. Sakaguchi, J. Organomet. Chem., 696, 61 (2011)
11) M. Yoshimura, N. Shibata, M. Kawakami, S. Sakaguchi, Tetrahedron, 68, 3512 (2012)
12) S. Sakaguchi, T. Yamaga, Y. Ishii, J. Org. Chem., 66, 4710 (2001)
13) H. Chiyojima, S. Sakaguchi, Tetrahedron Lett., 52, 6788 (2011)
14) S. Kawabata, H. Tokura, H. Chiyojima, M. Okamoto, S. Sakaguchi, Adv. Synth. Catal., 354, 807 (2012)
15) Y. Shimakawa, T. Morikawa, S. Sakaguchi, Tetrahedron Lett., 51, 1786 (2010)
|